맙소사! 인보사…세포·유전자 치료제 '직격탄'
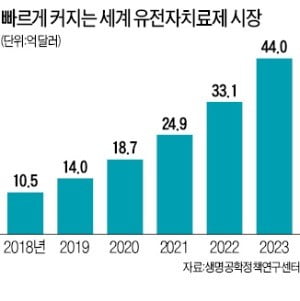
그러나 이번 문제가 의약품이나 임상 자체의 문제가 아니라 기술 진보 때문에 발생했다는 점에서 긍정적으로 평가하는 시각도 있다. 의약품 개발 기술이 발전하면서 겪어야 할 성장통이라는 것이다. 세포 및 유전자 치료제는 개발이 어렵고 고난도 기술이 필요한 첨단 치료제다. 유전자 편집 기술과 장비가 발달하면서 개발자뿐만 아니라 규제 기관도 의약품 개발 전 과정을 통제하기 어렵게 됐다. 연구자조차도 개발 중인 세포와 유전자가 어디에서 유래했는지, 어떻게 변화할지, 형질이 변경된 세포를 어떻게 정의해야 할지 판단과 예측이 불가능한 상황이 도래하고 있다. 임상 기간은 10년 이상으로 장기간인데 인공지능(AI)과 빅데이터 등의 기술은 비약적으로 발전하면서 임상 설계가 현실에 뒤처지는 격차도 생기고 있다.
업계 관계자는 “우리나라는 혁신 치료제 개발 역량을 갖춘 인력도 부족하고 장비와 시스템도 미국, 유럽 등에 뒤처지는 게 현실”이라며 “이번 일을 반면교사로 삼아 규제 기관과 바이오벤처가 글로벌 수준의 임상 역량을 키워야 한다”고 말했다.
전예진 기자 ace@hankyung.com
-
기사 스크랩
-
공유
-
프린트










![르세라핌, 美서 라이브 '대참사'…'K팝 아이돌' 논란 터졌다 [이슈+]](https://timg.hankyung.com/t/560x0/photo/202404/01.36438208.3.jpg)